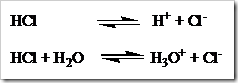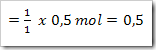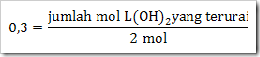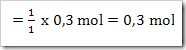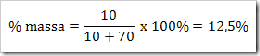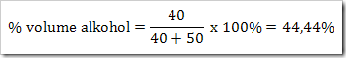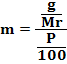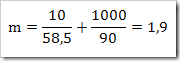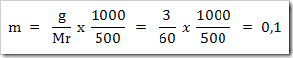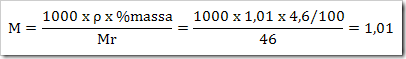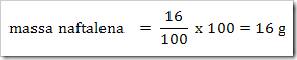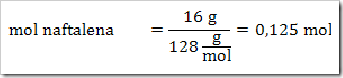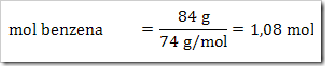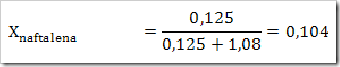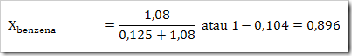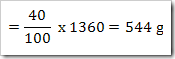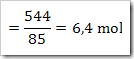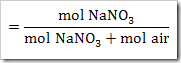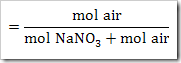Seperti yang telah disinggung pada bab sebelumnya bahwa senyawa dapat digolongkan menjadi senyawa ionik dan senyawa kovalen. Senyawa yang terbentuk dengan akibat adanya pemakain bersama elektron dinamakan senyawa kovalen sedangkan senyawa yang terbentuk karena tarikan antara dua ion yang berbeda muatan disebut senyawa ionik.
Cara lain untuk mengelompokan senyawa yaitu berdasarkan daya hantar listrik. Jika suatu senyawa dilarutkan dalam air dapat menghantarkan arus listrik disebut larutan elektrolit, dan sebaliknya jika larutan tersebut tidak dapat menghantarkan arus listrik disebut larutan nonelektrolit. Glukosa (C6H12O6), etanol (C2H5OH), gula tebu (C12H22O11), larutan urea (CONH2)2 merupakan beberapa contoh senyawa yang dalam bentuk padatan, lelehan maupun larutan tidak dapat menghantarkan arus listrik.
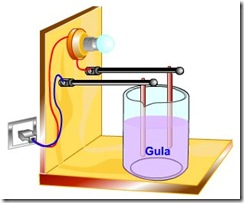
Cara pengujian suatu senyawa termasuk elektrolit atau nonelektrolit dapat dilakukan dengan meghubungkan baterai dan lampu bohlam atau amperemeter yang dapat digunakan untuk mengatakan besarnya arus listrik yang melewati rangkaian. Kemudian ujung kabel dihubungkan pada dua buah elektroda.
Setelah semua terhubung pengujian dapat dilakukan dengan mencelupkan kedua elektroda ke dalam larutan yang akan diuji. Ketika dicelupkan diperhatikan agar kedua elektrode tidak bersentuhan. Ketika elektroda dicelupkan jika lampu bohlam menyala maka dapat dikatakan senyawa tersebut termasuk golongan senyawa elektrolit. Begitu pula sebaliknya apabila ketika elektroda dicelupkan lampu bohlam tidak menyala maka dapat dikatakan senyawa tersebut termasuk golongan senyawa nonelektrolit.
Gambar rangkaian pengujian larutan elektrolit dan non elektrolit
Mengapa Larutan Menghantarkan Arus Listrik
Larutan elektrolit dapat menghantarkan sedangkan larutan nonelektrolit tidak menghantarkanarus listrik, telah dijelaskan oleh seorang ahli kimia swedia Svante August Arrhenius (1859-1927). Menurut Arhenius larutan elektrolit dapat menghantarkan arus listrik karena di dalam larutan tersebut terkandung atom-atom atau kumpulan atom yang bermuatan listrik (ion) yang bergerak bebas.
Misalnya reaksi yang tejadi pada elektrolisis larutan tembaga klorida (CuCl). Ketika tembaga klorida dilarutkan dalam air tembaga klorida akan terurai menjadi ion Cu2+ dan ion 2Cl‾ yang terpisah satu sama lain dan bercampur dengan air. Ketika elektroda dicelupkan ion Cu2+ akan bergerak ke elektroda yang dihubungkan dengan kutub negatif dari baterai sedangkan Cl‾ akan bergerak ke elektroda yang dihubungkan dengan kutub positif dari baterai. Elektroda yang dihubungkan dengan kutub negatif baterai disebut katoda, oleh sebab itu katoda bermuatan negatif. Sedangkan elektroda yang bermuatan positif dan dihubungkan dengan kutub positif disebut anoda.
Dari proses elektrolisis ini pada anoda akan keluar gas klor yang berwarna kuning kehijauan sedangkan pada katoda ion Cu2+ akan direduksi menjadi Cu padat yang akan berkumpul menutupi elektroda dari katoda. Setengah reaksi yang terjadi pada katoda dan anoda adalah
Sumber Ion
Ion-ion yang timbul dalam larutan elektrolit terdiri dari dua sumber yaitu ion yaga berasal dari senyawa ionik dan ion yang berasal dari senyawa kovalen polar. Semua senyawa ionik yang larut dalam air adalah elektrolit sedangkan senyawa lain yang larut dalam air ada yang elektrolit ada pula yang nonelektrolit.
Senyawa Ion
Senyawa ionik tersusun atas ion-ion baik dalam bentuk padat dan kering sekalipun. Senyawa-senyawa ionik dalam keadaan padat tidak dapat menghantarkan arus listrik karena tidak ada pergerakan dari ion-ion tersebut. Namun apabila senyawa ionik dilarutkan dalam suatu pelarut polar misalnya air maka senyawa ionik adalah suatu elektrolit. Perlu diketahui bahwa semua senyawa ionik yang dilarutkan dalam air dan lelehan senyawa ionik dari padatannya merupakan suatu elektrolit. Hal ini disebaabkan ion-ion yang ada bebas bergerak ke segala arah. Untuk senyawa ionik yang dilelehkan dari padatannya memiliki daya hantar listrik yang lebih baik dibanding larutannya.
Air merupakan suatu pelarut yang baik untuk senyawa-senyawa ionik namun tidak memainkan peran yang istimewa dalam menghantarkan arus listrik. Air hanya dijadikan medium oleh ion-ion untuk bergerak.
Senyawa kovalen polar
Senyawa-senyawa kovalen baik kovalen polar maupun nonpolar dalam keadaan normal tidak dapat menghantarkan arus listrik. Tetapi berdasarkan penelitian larutan dari senyawa kovalen polar dapat menghantarkan arus listrik jika dilarutkan dalam pelarut yang sesuai. Hal ini disebabkan senyawa kovalen polar dalam pelarut yang sesuai mampu membentuk ion-ion yang bergerak bebas. Misalnya senyawa kovalen polar mampu membentuk ion di dalam air tetapi tidak mamp membentuk ion di dalam benzena. HCl, NH3 dan CH3COOH merupakan beberapa contoh senyawa kovalen polar.
Perubahan suatu senyawa menjadi ion-ion disebut proses ionisasi. Proses ionisasi merupakan salah satu cara menunjukan pembentukan ion-ion, umumnya ditulis tanpa melibatkan molekul air atau pelarut, namun terkadang molekul air dituliskan juga. Misalnya HCl yang dilarutkan dalam air dapat ditulis dalam dua persamaan:
Reaksi ionisasi dari CH3COOH dan NH3 dalam air dapat dilihat pada persamaan di bawah:
Penggolongan Elektrolit
Larutan elektrolit dapat digolongkan menjadi dua jenis yaitu
1. Elektrolit kuat
2. Elektrolit lemah
Dari tiga senyawa di atas HCl, CH3COOH dan NH3, apabila diuji daya hantar listrik menggunakan konsentrasi larutan yang sama misalnya 1 M. maka dapat diketahui ternyata HCl memiliki daya hantar listrik yang lebih baik dibanding dua senyawa lainnya. Hal ini dapat dilihat pada lampu bohlam yang menyala lebih terang.
Dari hal ini dapat disimpulkan bahwa jumlah ion yang terbentuk dari HCl lebih banyak jika dibandingkan dengan dua senyawa tersebut. Artinya di dalam air sebagian besar HCl terurai menjadi ion H+ dan ion Cl‾ sedangkan CH3COOH dan NH3 hanya sebagian kecil yang terurai ion H3O+ dan ion CH3COO‾ dan NH4+ dan OH‾, sebagian besarnya masih tetap dalam bentuk molekul kovalen.
Untuk senyawa-senyawa ionik yang dilarutkan didalam air ternyata memiliki daya hantar listrik yang baik. Hal ini disebabkan senyawa ionik tersusun atas ion-ion dan ketika dilarutkan dalam air ion-ion tersebut akan langsung menyebar secara merata di dalam air.
Zat-zat yang seluruhnya atau hampir seluruhnya di dalam air terurai menjadi ion-ion sehingga memiliki daya hantar listrik yang baik disebut elektrolit kuat. Natrium klorida, asam sulfat, asam klorida, dan NaOH merupakan beberapa contoh elektrolit kuat. Senyawa yang termasuk elektrolit kuat mempunyai daya hantar listrik yang relatif baik walaupun memiliki konsentrasi yang kecil.
Sebaliknya beberapa senyawa kovalen polar yang larut dalam air merupakan penghantar listrik yang jelek. Di dalam air zat-zat yang hanya sebagian kecil molekulnya terurai menjadi ion disebut elektrolit lemah. Lartuan asam asetat dan amonia dalam air merupakan contoh elektrolit lemah. Pada elektrolit lemah mempunyai daya hantar yang relatif jelek walaupun memiliki konsentrasi tinggi (pekat).
Dari percobaan daya hantar listrik, elektrolit kuat akan memberikan nyala bohlam yang terang sedangkan elektrolit lemah nyala bohlamnya redup atau hanya menimbulkan gelembung-gelumbung udara pada elektroda. Jika tidak ada reaksi atau perubahan, maka dapat dikatakan larutan tersebut termasuk larutan nonelektrolit.
Larutan elektrolit dapat berupa asam, basa dan garam. Untuk asam dan basa dapat berupa elektrolit kuat dan elektrolit lemah. Sedangkan garam yang mudah larut dalam air semuanya termasuk elektrolit kuat, sedangkan garam-garam yang sukar larut dalam air berupa elektrolit lemah walaupun tersusun atas ion-ion.
Beberapa senyawa yang tergolong elektrolit kuat adalah
1) Asam-asam kuat umumnya asam-asam anorganik, misalnya: HCl, HClO3, H2SO4 dan HNO3.
2) Basa-basa kuat yaitu basa-basa golongan alkali dan alkali tanah, misalnya: NaOH, KOH, Ca(OH)2 dan Ba(OH)2.
3) Garam-garam yang mudah larut, misalnya: NaCl, KI dan Al2(SO4)3
Beberapa senyawa yang tergolong elektrolit lemah
1) Asam-asam lemah, sebagian asam anorganik dan sebagian besar asam organik misalnya: CH3COOH, HCN, H2CO3 dan H2S
2) Basa-basa lemah, misalnya amonia dan kebanyakan basa organik seperti NH4OH dan Ni(OH)2
3) Garam-garam yang sukar larut, misalnya: AgCl, CaCrO4 dan PbI2
Kegiatan Laboratorium
Lakukan kegiatan berikut untuk menguji daya hantar listrik beberapa zat.
Alat dan Bahan
- Gelas kimia 100 ml
- Baterai
- Air suling 50 mL
- Larutan HCl 1M 50 mL
- Larutan asam cuka (CH3COOH) 1M 50 mL
- Larutan NaOH 1M 50 mL
- Larutan ammonia (NH3) 1 M 50 mL
- Larutan gula 50 mL
- Larutan NaCl 1M 50 mL
- Etanol 70% 50 mL
- Air leding dan air sumur 50 mL
Beberapa hal yang perlu diperhatikan dan catat pada lembar pengamatan
1) Amati dengan seksama, apa yang terjadi pada lampu dan batang elektroda
2) Diantara bahan yang diuji, manakah yang dapat menghantarkan arus listrik dan manakah yang tidak dapat menghantarkan listrik.
3) Jika ada yang menghantarkan arus listrik manakah yang termasuk elektrolit kuat dan manakah yang termasuk elektrolit lemah.
4) Diantara larutan elektrolit di atas, manakah zat terlarutnya yang memiliki ikatan ion dan ikatan kovalen.
Derajat Ionisasi
Ketika suatu zat dilarutkan dalam air, maka terdapat 3 kemungkinan yang terjadi yakni zat tersebut larut secara sempurna, larut sebagian dan tidak larut dalam air. Banyaknya spesi yang terionisasi dalam air dapat diketahui menggunakan derajat ionisasi (α). Derajat ionisasi diartikan sebagai perbandingan jumlah mol atau molekul zat yang terurai atau terionisasi dengan banyaknya mol atau molekul zat mula-mula. Derajat ionisasi dapat ditulis sebagai
Harga α di antara 0 ≤ α ≥ 1. α = 0 artinya tidak terjadi ionisasi. Sedangkan α = 1 artinya terjadi ionisasi secara sempurna.
Contoh soal 1
Bila diketahui suatu reaksi sebagai berikut
Dari reaksi di atas tentukan derajat ionisasinya, apabila mula-mula 2 mol asam asetat dilarutkan dalam air dan menghasilkan ion H+ sebanyak 0,5 mol.
Jawab
Dari reaksi yang ada maka CH3COOH yang terurai adalah
Maka derajat ionisasinya adalah
Contoh soal 2
Suatu basa dengan rumus L(OH)2 bila dilarutkan dalam air teionisasi sesuai reaksi berikut:
Jika mula-mula L(OH)2 sebanyak 2 mol dengan derajat ionisasi sebesar 0,3. Tentukanlah
a. Jumlah mol L(OH)2 yang terionisasi
b. Jumlah mol ion L2+ yang terbentuk
c. Jumlah mol L(OH)2 yang tersisa setelah terionisasi
Jawab
Reaksi ionisasi : L(OH)2 ––→ L2+ + 2OH‾
a. Jumlah mol L(OH)2 yang terionisasi
b. Jumlah mol ion L2+ yang terbentuk
* SMA KELAS I bpj, fraksi mol, hubungan fraksi mol dengan kemolalan dan kemolaran, hubungan molaritas larutan dengan % massa, Konsentrasi Larutan, larutan, larutan elektrolit dan nonelektrolit, malalitas, massa molar,molal, molar, molaritas, pelarut, persen massa, persen volume, ppb, ppm, ppm dan ppb, zat terlarut